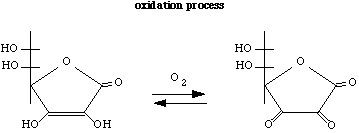
D'abord il y a une transformation du réducteur acide ascorbique à son oxydant, l'acide déhydroascorbique, et la perte de 2 électrons et 2 atomes d'hydrogène.
C6H8O6 (aq) --> CH6O6 (aq) + 2e- + 2H
Acide ascorbique (réduit) --> Acide déhydroascorbique (oxydé) + électrons + atomes d'hydrogène
Ensuite les atomes d'hydrogène vont venir réagir avec l'oxydant, le dioxygène le transformer en son réducteur, l'eau. (Pour créer un équilibre dans l'équation on a ajouté 2 atomes d'hydrogène).
O2 (g) + 4e- + 4H --> 2H2O (aq)
Dioxygène (oxydé) + électrons + atomes d'hydrogène --> H2O (réduit)
SOURCES:
- Chemistry-software.com. http://www.netsci-journal.com/97v4/97014/vitc2.html. Utilisé le 23.01.14
- DURUPTHY André, Chimie 1reS, Hachette Education, 2005
Aucun commentaire:
Enregistrer un commentaire